|
Начало раздела Производственные, любительские Радиолюбительские Авиамодельные, ракетомодельные Полезные, занимательные |
Хитрости мастеру Электроника Физика Технологии Изобретения |
Тайны космоса Тайны Земли Тайны Океана Хитрости Карта раздела |
|
| Использование материалов сайта разрешается при условии ссылки (для сайтов - гиперссылки) | |||
Навигация: => |
На главную/ Каталог патентов/ В раздел каталога/ Назад / |
|
ИЗОБРЕТЕНИЕ
Патент Российской Федерации RU2167211
![]()
ЭКОЛОГИЧЕСКИ ЧИСТЫЙ СПОСОБ ИЗВЛЕЧЕНИЯ БЛАГОРОДНЫХ МЕТАЛЛОВ
ИЗ МАТЕРИАЛОВ, ИХ СОДЕРЖАЩИХ
Имя изобретателя: Гуров Владимир Алексеевич
Имя патентообладателя: Гуров Владимир Алексеевич; Дорофеев Юрий Никанорович; Кольцов Василий Юрьевич; Снигирь Александр Николаевич
Адрес для переписки:
Дата начала действия патента: 2000.10.26
Изобретение относится к металлургии, а именно к способам извлечения благородных металлов.
Способ извлечения благородных металлов из материалов, их содержащих, включает выщелачивание материалов раствором, содержащим хлорид-ионы, введение в выщелачиваемый раствор серной кислоты и перекиси водорода, последующую переработку продуктивного раствора с извлечением благородных металлов и возвращение переработанного раствора на выщелачивание. При этом серную кислоту и перекись водорода вводят в выщелачивающий раствор в виде смеси, причем смешивание осуществляют путем введения перекиси водорода в серную кислоту при молярном соотношение 2SO4 : H2O2> 1 и при охлаждении. Использование изобретения позволяет снизить расход реагентов и повысить экологическую безопасность и чистоту процесса.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к металлургии, а именно к способам получения благородных металлов, и может быть использовано для извлечения золота, серебра и металлов платиновой группы из руд, концентратов, огарков, хвостов, отработанных катализаторов, электронного лома и т.п.
Известен способ извлечения благородных металлов из руд, концентратов, отходов и вторичного сырья раствором, содержащим ионы H, Cl и NO3, например раствором, содержащим 50-350 г/л NCl и 3-50% HNO3при температуре 20-110oC. После выделения металлов из раствора отработанный раствор возвращают в процесс (DE 2418441).
Недостатками способа являетсябольшой расход азотной кислоты, т.к. для эффективности процесса необходима ее высокая концентрация, а и невысокая экологическая безопасность способа ввиду получения в качестве отходов окиси азота.
В качестве прототипа выбран способ извлечения благородных металлов из материалов, их содержащих, включающей обработку материалов оборотным выщелачивающим раствором смеси соляной и серной кислот с добавкой перекиси водорода с последующей переработкой продуктивного раствора ("Rh, Pt and Pd Recovery from New and Apent Automative Catalysts" // Wu Koo Ying et. al. Precious Metals, 1993, N 17, p. 343-349).
В данном способе добавка перекиси водорода в раствор соляной и серной кислот приведет к повышенному расходу реагентов, что и повышает вероятность образования и выделения элементарного (газообразного) хлора в количестве, снижающем экологическую безопасность и чистоту процесса.
Задачей, решаемой изобретением, является снижение расхода реагентов и повышение экологической безопасности и чистоты процесса.
Решение поставленной задачи достигается тем, что в способе извлечения благородных металлов из материалов, их содержащих, включающем выщелачивание материалов раствором, содержащим хлорид-ионы, введение в выщелачивающий раствор серной кислоты и перекиси водорода, последующую переработку продуктивного раствора с извлечением благородных металлов и возвращение переработанного раствора на выщелачивание, серную кислоту и перекись водорода вводят в выщелачивающий раствор в виде смеси, причем смешивание осуществляют путем введения перекиси водорода в серную кислоту при молярном соотношении H2SO4:H2O2> 1 и при охлаждении.
Сущность изобретения состоит в следующем. При введении в выщелачивающий раствор, содержащий хлорид-ионы, серной кислоты, как на холоду, так и при нагреве образуется смесь серной и соляной кислот по реакции
2Cl- + H2SO4 = SO42-+ 2HCl (1)
Окислительное действие перекиси водорода описывается полуреакцией
H2O2 + 2H+ + 2e = 2H2O, (2)
значение стандартного окислительно-восстановительного потенциала (ОВП) которой равно + 1,776 в.
Реакции растворения благородных металлов, например золота и платины, с участием соляной кислоты и перекиси водорода будут иметь вид
2Au + 3H2O2 + 8HCl = 2HAuCl4 + 6H2O (3)
Pt + 2H2O2 + 6HCl = H2PtCl6+ 4H2O (4)
При этом стандартные ОВПрастворения в хлоридной среде золота (+1,0 в) и платины (+0,7 в) значительно ниже ОВПперекиси водорода. Однако реально окислительная активность перекиси водорода проявляется только при высокой кислотности и значительной концентрации перекиси водорода и хлорид-ионов в растворе. Вместе с тем если предварительно смешать концентрированные перекись водорода и серную кислоту, то часть серной кислоты и перекиси водорода образуют надсерную и мононадсерную кислоты по реакциям
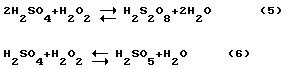
Надсерная и мононадсерная кислоты являются значительно более сильными и активными окислителями, чем перекись водорода (ОВП = 2,12 в). Реакции (5, 6) заметно обратимы и обе надсерные кислоты и разлагаются при разбавлении и повышенной температуре, как и перекись водорода. Однако если смесь концентрированных перекиси водорода и серной кислоты готовить при охлаждении в пределах температуры 0-30oC и применять непосредственно после приготовления, то большая часть перекиси водорода превращается в мононадсерную кислоту.
Кроме того, имеет значение порядок смешивания перекиси водорода и серной кислоты. Если вводить серную кислоту в перекись водорода, то при смешивании будет наблюдаться разбавление образующихся надсерных кислот водой и их разложение, вначале до перекиси водорода, а затем до кислорода. В результате будет происходить непроизводительная потеря используемой перекиси водорода. Если же вводить перекись водорода в серную кислоту, то надсерные кислоты будут разбавляться серной кислотой, которая повышает их устойчивость. В результате конверсия перекиси в надсерные кислоты будет значительно более полной. По этим же причинам молярная концентрация серной кислоты в готовой смеси должна превышать молярную концентрацию перекиси водорода. Другими словами, готовая смесь должна содержать молярный избыток серной кислоты в соответствии с реакцией (6), т.е. должно соблюдаться соотношение H2SO4:H2O2> 1
При введении в выщелачивающий раствор перекиси водорода в виде смеси с серной кислотой полученные надсерные кислоты разлагаются, но значительно медленнее, чем сама перекись водорода. Кроме того, перекись водорода разлагается на кислород и воду, а надсерные кислоты в значительной степени разлагаются на озон. И если кислород в этих условиях не является окислителем для благородных металлов, то образующийся озон и является окислителем, и более сильным и активным, чем перекись водорода. В результате предварительное смешивание перекиси водорода с серной кислотой приведет к одновременному активированию и стабилизации перекиси водорода. Следствием этого обстоятельства является реальная возможность поддерживать значительно меньшую концентрацию окислителя, кислоты и хлорид-ионов в выщелачивающем растворе, обеспечивая при этом растворение благородных металлов. В результате расход сократится.
ОВП образования элементарного хлора имеет значение +1,36 в и находится между значениями ОВП благородных металлов и перекиси водорода. Полуреакция образования хлора имеет вид
Cl2 + 2e = 2Cl- (7)
И хотя из полуреакции (7) следует, что вероятность образования элементарного хлора зависит только от концентрации хлорид-ионов, на самом деле она зависит и от кислотности раствора. Дело в том, что элементарный хлор гидролизуется с образованием хлорноватистой кислоты, имеющей ОВП значительно больший, чем у хлора (+1,63 в), а повышенная кислотность подавляет гидролиз и облегчает окисление хлорид-ионов в элементарный хлор. Поэтому если вести выщелачивание при повышенной кислотности и концентрации хлорид-ионов, то вероятность образования элементарного хлора повышается. И наоборот, при пониженной концентрации кислоты и хлорид-ионов эта вероятность снижается. Таким образом, возможность поддерживать меньшие концентрации окислителя, кислоты и хлорид-ионов при добавлении перекиси водорода в виде смеси уменьшает вероятность образования элементарного хлора и повышает экологическую безопасность и чистоту процесса.
Вся вводимая перекись водорода может смешиваться с частью всей вводимой серной кислоты, когда кислотность необходимо поддерживать относительно высокой, например при выщелачивании платины. В этом случае другая часть серной кислоты вводится в выщелачивающий раствор до добавления перекисной смеси. В случае необходимости поддержания невысокой кислотности, например при выщелачивании рудного золота, вся перекись смешивается со всей вводимой серной кислотой и оба реагента добавляются в выщелачивающий раствор только в виде смеси. Соотношение количества перекиси водорода и серной кислоты в смеси может изменяться довольно широко: в зависимости от концентраций этих реагентов в исходных реактивах, а и от кислотной и восстановительной емкости выщелачиваемых руд и материалов. Главное, чтобы и в ходе приготовления смеси, и по окончании в готовой смеси обеспечивался молярный избыток серной кислоты. Предпочтительно, чтобы перекись водорода содержалась в исходном реактиве в пределах 30-60%, а серная кислота - в пределах 92-98%. При агитационном варианте процесса перекисная смесь может дозироваться непосредственно в выщелачиваемую пульпу как на холоду, так и при нагреве. В случае кучного и подземного выщелачивания благородных металлов смесь перекиси водорода и серной кислоты можно добавлять в выщелачивающий раствор непосредственно перед подачей его на выщелачивание руд. Источником хлорид-ионов в выщелачивающем растворе могут служить как хлориды щелочных и щелочноземельных металлов, так и соляная кислота, а и хлориды алюминия и другие хлориды. Переработка продукционного раствора осуществляется традиционными методами: сорбцией, электролизом или цементацией, с возвратом оборотного раствора на выщелачивание.
По известному и предлагаемому вариантам осуществляли обработку платиносодержащего алюмооксидного катализатора выщелачивающим раствором, содержащим хлорид алюминия. Обработку проводили при перемешивании на магнитных мешалках и температуре 80oC в герметично закупоренных стеклянных сосудах. Сосуды были оборудованы приспособлениями для дозировки реагентов и отвода газов через гидрозатворы, заполненные раствором едкого кали 200 г/л. По известному варианту концентрации в растворе составляли: Cl - 8М, H2SO4- 2,5М, 30% перекись водорода дозировалась в течение 1 часа в различном количестве из расчета от 10 до 100 г на 1 кг катализатора.
По предлагаемому варианту концентрации составляли: Cl - 2М, H2SO4- 0,5М. Смесь 30% перекиси водорода и 92%серной кислоты готовилась из расчета: 1 объем серной кислоты и 1 объем перекиси водорода. Перекись водорода вводилась в серную кислоту при поддержании температуры смеси 15oC охлаждением захоложенной водой. Молярная концентрация серной кислоты в смеси составила -8,6 М, перекиси водорода -5 М, то есть смесь содержала значительный молярный избыток серной кислоты. Полученная смесь и дозировалась в течение 1 часа в различном количестве из расчета по перекиси водорода от 5 до 15 г на 1 кгкатализатора. По окончании обработки по обоим вариантам пульпы отфильтровывались, в растворах определялись концентрации серной кислоты и платины, по которым рассчитывались степень извлечения и удельный вес серной кислоты. При этом в растворах едкого кали в гидрозатворах определялся активный хлор и рассчитывался удельный выход газообразного хлора в ходе обработки. Результаты представлены в таблице.
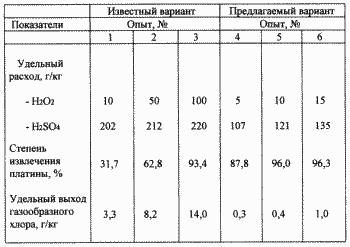
Из данных таблицы следует, что по известному варианту высокая степень извлечения платины 93,4% достигается только при удельном расходе перекиси водорода в 100 г/кг катализатора и серной кислоты 220 г/кг. При этом удельный выход газообразного хлора составил 14 г/кг. По предлагаемому варианту уже при удельном расходе перекиси водорода - 10 г/кг и серной кислоты - 121 г/кг извлекается 96%платины, а удельный выход газообразного хлора составил только 0,4 г/кг. Таким образом, по предлагаемому варианту значительно сокращается расход реагентов, а экологическая безопасность и чистота процесса повышаются.
ФОРМУЛА ИЗОБРЕТЕНИЯ
Способ извлечения благородных металлов из материалов, их содержащих, включающий выщелачивание материалов раствором, содержащим хлорид-ионы, введение в выщелачивающий раствор серной кислоты и перекиси водорода, последующую переработку продуктивного раствора с извлечением благородных металлов и возвращение переработанного раствора на выщелачивание, отличающийся тем, что серную кислоту и перекись водорода вводят в выщелачивающий раствор в виде смеси, причем смешивание осуществляют путем введения перекиси водорода в серную кислоту при молярном соотношении H2SO4 : H2O2> 1 и при охлаждении.
Версия для печати
Дата публикации 07.11.2006гг
Created/Updated: 25.05.2018
 |
|
